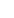美國食品藥品監督管理局(FDA)今日發布通知,告知消費者強生醫療科技公司旗下 Abiomed 的 Impella RP 心臟泵的最新使用說明。

Impella RP 可為在植入左心室輔助裝置(LVAD)后出現急性右心衰竭的患者提供長達 14 天的支持。該裝置置于頸內靜脈,通過將血液泵入肺動脈來支持心臟的右心房。
Abiomed 針對部分 Impella RP 設備更新了使用說明,但此次召回并不涉及從使用地點或銷售地點移除這些設備。FDA 將此次召回認定為最嚴重的類型。如果消費者不遵循最新使用說明繼續使用該設備,可能會導致嚴重傷害甚至死亡。
該公司表示,截至目前尚未收到與該問題相關的傷害或死亡報告。這是 Impella 泵的又一次召回事件。去年,另一版本的 Impella 泵也曾被召回,該事件涉及 49 例死亡案例。此次的 RP 版本在 2023 年也曾有過一次一級召回。

去年 12 月,Abiomed 向受影響的客戶發布了緊急醫療器械整改通知。該通知涉及所有配備智能輔助功能的 Impella RP 和配備智能輔助功能的 Impella RP Flex 設備。
該公司發現,在插入、調整或移除過程中,導絲尖端或其他醫療器械存在與 Impella 泵接觸的風險。這可能導致光學傳感器損壞、泵暫時停止運轉或永久停止運轉。這可能會觸發警報,并導致某些心臟和血壓讀數丟失
注:文章來源于網絡,如有侵權,請聯系刪除




 全部商品分類
全部商品分類