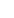在醫療器械行業,質量管理體系標準是確保產品安全性和有效性的關鍵。全球醫療器械主流體系GMP、QSR 820、ISO 13485和MDSAP各有其獨特的適用范圍和核心目標,企業在選擇適合的質量管理體系時,應根據自身的市場定位和產品需求進行綜合考慮。
為了幫助制造商準確抉擇,本文將詳細解析GMP、QSR 820、ISO 13485和MDSAP四大體系,從全稱、定義與性質、適用范圍、參與國家/地區、核心目標、主要內容、審核與認證、風險管理及其他說明等多角度作對比分析。
1. 全稱
GMP:Good Manufacturing Practice(良好生產規范)
ISO 13485:Medical devices-Quality management systems-Requirements for regulatory purposes(醫療器械-質量管理體系-法規要求)
QSR 820:Quality System Regulation(質量體系法規)
MDSAP:Medical Device Single Audit Program(醫療器械單一審核程序)
2. 定義與性質
GMP:GMP是藥品和醫療器械生產過程中的質量和安全標準體系,旨在確保產品在生產過程中始終保持高質量和安全性。
ISO 13485:ISO 13485是國際標準,規定醫療器械制造商應遵循的質量管理體系要求。
QSR 820:QSR 820是美國FDA制定的醫療器械質量管理的法規要求。
MDSAP:通過一次審核滿足多個國家/地區的市場準入要求。
3. 適用范圍
GMP:適用于藥品和醫療器械的生產過程,涵蓋從原材料采購到成品出廠的全過程。
ISO 13485:適用于醫療器械制造商的設計、開發、生產、安裝和服務等環節。
QSR 820:適用于美國境內的醫療器械制造商。
MDSAP:主要適用于醫療器械制造商,還涉及分銷商和售后服務等環節。
4. 參與國家/地區
GMP:全球范圍,但標準由各國獨立實施。
ISO 13485:全球范圍。
QSR 820:美國。
MDSAP:美國、加拿大、巴西、澳大利亞、日本。
5. 核心目標
GMP:確保持續穩定地生產出符合預定用途和注冊要求的藥品和醫療器械。
ISO 13485:確保醫療器械的質量和安全性符合法規要求。
QSR 820:確保醫療器械成品的安全和有效,并遵從美國食品、藥品和化妝品法。
MDSAP:通過一次審核滿足多國市場準入要求,減少重復審核。
6. 主要內容
GMP:人員、設備、環境、原材料、生產工藝和產品質量的全面控制。
ISO 13485:質量管理體系的建立、運行、維護和改進。
QSR 820:設計控制、生產控制、采購控制、不合格品控制等。
MDSAP:涵蓋ISO 13485標準和參與國家/地區的法規要求。
7. 審核與認證
GMP:藥品監管部門或其認可的機構開展GMP審核和認證。
ISO 13485:由第三方認證機構進行ISO 13485認證。
QSR 820:FDA或其認可的機構進行監管和審核。
MDSAP:由參與國家/地區的授權審核機構進行一次性綜合審核。
8. 風險管理
GMP:通過全過程控制以最大限度減少生產過程中的風險。
ISO 13485:基于風險的方法,要求企業識別、評估、控制與產品相關的風險。
QSR 820:要求制造商實施風險管理以確保產品安全性和有效性。
MDSAP:強調合規性和市場準入,關注質量管理體系中的風險管理。
9. 其他說明
GMP:國外對"良好生產管理規范"的英文縮寫,包括食品行業、醫療器械、藥品的GMP,是不同行業的產品生產管理和質量管理的基本準則甚至法規。醫療器械領域俗稱的GMP指《醫療器械生產質量管理規范》(即國家藥品總局2014年第64號公告)。
ISO 13485:歐盟認可ISO 13485體系,但在體系搭建過程中還需要滿足MDR或IVDR對于QMS的獨立要求。
QSR 820:美國認可的體系是QSR 820,屬于產品上市后抽查制度,未來FDA會向ISO 13485看齊,但需逐步過渡。
MDSAP:目前加拿大和澳大利亞對MDSAP接受程度較高,其他幾個國家仍然有其自身獨立的體系要求,如美國QSR 820、日本J-GMP、巴西B-GMP,這三國的MDSAP并不能完全代替本土體系審核。
注:文章來源于網絡,如有侵權,請聯系刪除




 全部商品分類
全部商品分類